

거지의 정체 태풍과 함께 사라진 아버지


1) 분율
-
전체의 양 중에서 성분 물질이 차지히는 비율
-
1에 가까울수록 특정 성분이 많은 부분을 차지하고 있다는 의미,0에 가까울수록 특성 성분이 적은 부분을 차지하고 있다는 의미
-
분율에는 질량을 기준으로 하는 질량 분율과 부피를 기준으로 하는 부피 분율이 있으며 상황에 따라서 적용하기 쉬운 기준을 사용
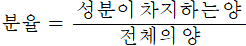

어느 학급의 남학생과 여학생 수가 각각 17명, 18명으로 구성되어 있다. 남학생과 여학생이 차지하는 분율을 각각 구하시오.

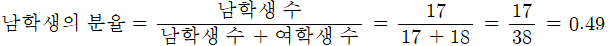

남학생의 분율과 여학생의 분율의 합은 1이다
2) 퍼센트 농도
-
퍼센트 농도는 전체를 100으로 두었을 때, 특정 성분이 그 중의 얼마를 차지하는가를 나타내는 것으로, 분율에 100을 곱한 값
-
퍼센트 농도에는 중량 퍼센트 농도와 부피 퍼센트 농도가 있음
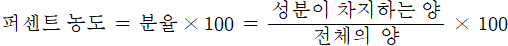

학급 인원이 35명인 어느 학급 반장 선거에서 2명의 후보가 추천되어 투표한 결과 득표수가 A후보 20표, B후보 15표가 나왔다. 각각의 후보가 득표한 백분율을 구하시오.

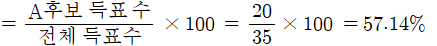
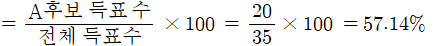
-
중량 퍼센트 농도
-
용액 100g 중에 함유되어 있는 용질의 양을 g수로 나타내며, %(w/w)로 표시

NaCI 수용액 100g 중에 40g 의 NaCI이 함유되어 있을 때, 이 수용액 중의 NaCI의 농도를 중량 백분율로 나타내시오.

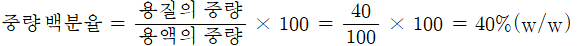
-
부피 퍼센트 농도
-
용질이 액체일 때 용액 100 mL중에 함유되어 있는 용질의 양을 mL수로나타낸 것이며, %(v/v)로 표시
-
용질이 고체일 때에는용액100mL 중에 함유되어 있는 용질의 양을 g수로 나타내고, %(w/v)로 표시

소주 300mL 중에 60mL의 순수한 에탄올(C2H5OH)이 함유되어 있을 때, 이 소주 중의 에탄올 농도를 부피 백분율로 나타내시오.

에탄올과 물은 모두 액체이므로 부피 백분율 농도 표시법 중 %(v/v)로나타낸다.
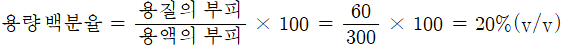
3) 백만분율
-
용액 백만(106g ) 중에 함유되어 있는 용질의 양을 g수, 단위는 ppm을사용
-
매우 희박한 농도를 나타내는 경우에 사용
-
예 : 검은 돌과 흰 돌이 섞여 있을 때, 검은 돌의 백만분율이 15ppm 이라면 백만 개의돌 중에 검은 돌이 15개
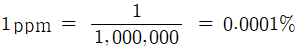

어느 하천의 수질 검사를 실시한 결과 하천수 5g 중에 납(Pb)이 0.001 mg 함유되어 있었다. 하천수 중의 납의 농도를 ppm으로 나타내시오.

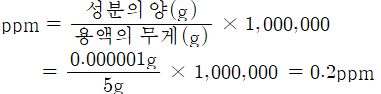
4) 몰 농도(M)
-
몰(mole)의 개념
-
화학에서 사용하는 단위로, 물질의 양을 나타낸다.
-
아보가드로수 만큼 존재할 때를 1몰이라고 하며, 분자량 또는 원자량에 g을 붙이면 그 물질의 1몰 질량


1몰의 질량과 입자수
-
몰 농도(mol/L)
-
용액 1L중에 포함되어 있는 용질의 몰수, 단위는 M
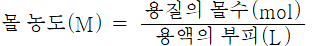

NaOH 용액 500mL 중에 NaOH가 4g 함유되어 있을 때, 이 용액의 몰 농도(M)를 계산하시오. (단, NaOH 1몰의 질량은 40g이다.)

몰농도는 용액 lL(1000mL) 중에 녹아 있는 용질의 몰수이므로 500mL : 4g = 1000mL : x
x = 8g, 몰수 계산은 질량을 분자량으로 나누면 되므로
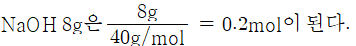
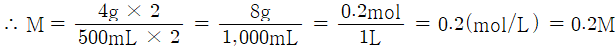
5) 몰랄 농도(m)
-
용매 1kg에 녹아 있는용질의 몰 수, 단위는 m
-
용매의 질량을 기준으로 계산하므로 부피를 기준으로 하는 몰농도와 다르게 온도 변화에 영향을 받지 않음.
6) 노말 농도(N)
-
당량수(eq)
-
당량이란 1몰의 전자, 수소 이온(H+ ), 수산화 이온(OH- )반응하거나 이를 생성하는물질의 양이다.
-
예를 들어 HCl 몰이 이온화되어 1몰의 H+를 생성하기 때문에 HCl의 당량수는 1 이다. 따라서 2몰의 HCl의 당량은 2가 된다.
-
당량 무게(g eq)
-
당량 무게는 시료의 분자량을 시료의 당량수로 나눈 값, 당량당 시료의 분자량
-
예 : 1몰의 H2S04는 이온화되어 2몰의 H+를 만들어 내기 때문에 당량수는 2이며, H2S04의 분자량은 98.08g/mol이므로 이를 당량수 2로 나누면 당량 무게는 49.04g/eq
-
노말 농도(N)
-
노말 농도는 단위 부피의 용액에 들어있는 당량수를 의미
-
2몰의 H2S04가 1L의 용액에 녹아 있다면, H2SO4의 당량수는 2이므로 2몰의 H2S04의 당량은 4가되며 용액의 노말농도는 4N
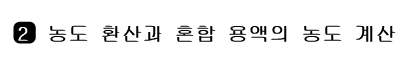
1) 농도 환산(% 농도 → 몰 농도)
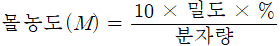
2) 농도 환산(%농도 → 노말 농도)
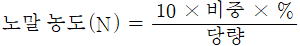
3) 농도 환산(몰 농도 → 노말 농도)
노말 농도(N) = 몰농도(M) x 당량
4) 혼합 용액의 농도 계산
-
농도가 M1과 M2인용액을 혼합하면 섞여진 혼합 용액의 농도 M3은 다음과 같은 관계식을 통해 계산
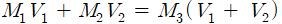
M1, M2 : 혼합 전 용액 1, 2의 몰 농도
V1, V2 : 혼합 전 용액 1, 2의 부피
M3 : 혼합 후 용액의 몰 농도

1M-NaOH 용액 500mL와 2M-NaOH 용액 1, 500mL를 혼합하였을 경우의 몰농도(M)를 계산하시오.

식 M1V1 + M2V2 = M3
(V1 + V2 )를 활용한다.
1M x 500mL + 2M x 1,500mL = M3 X 2,OOOmL
∴ M3 = 1.75M

▶ 길 ★ ROAD - Motivational Video





![]()

![]()


![]()
![]()
![]()


![]()
![]()


![]()


![]()
![]()


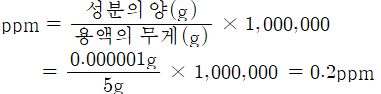
![]()

![]()


![]()
![]()
![]()
![]()
![]()

